只需要点击下方QQ发送“高考化学解题模型”,就可以免费领取《高考化学解题模型》了!
NO与O2混合,NO2与O2混合,NO、NO2、O2三者混合溶于水时都会生成硝酸,在确定最终得到的气体时可采用关系式法和电子守恒法。
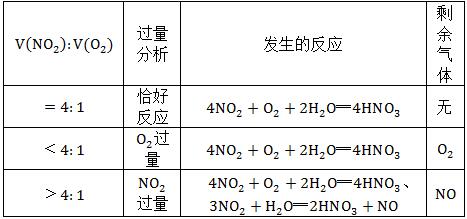
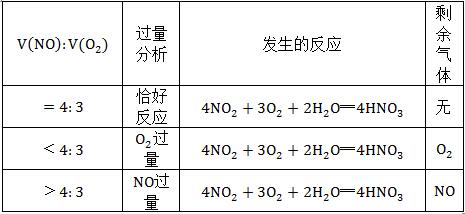
发生的反应主要有两个:①3NO2+H2O═2HNO3+NO ②2NO+O2═2NO2
由这两个基础反应可以构造出两个反应:
①×2+②得:4NO2+O2+2H2O═4HNO3
②×2+②×3得:4NO+3NO2+2H2O═4HNO3
1.关系式法
一般NO2、NO、O2与水的反应有四种情况:
(1) NO和NO2的混合
根据3NO2+H2O═2HNO3+NO利用差量法计算。
(2) NO2和O2混合
(3)NO和O2混合
(4)NO2、NO、O2混合
设NO2、NO的物质的量分别为x、y,再由上述构造出的两个反应得:
4xNO2+4yNO+(x+3y)O2+2(x+y)H2O═4(x+y)HNO3。当V(NO2):V(NO):V(O2)=1:1:1时,混合气体全部与水反应,无气体剩余。
2.电子守恒法
当NO2或NO转化为HNO3时要失去电子,若上述两种气体与O2混合,O2得电子,且得失电子数必然相等。在反应过程中1 mol O2参加反应得4 mol电子,1 mol NO2参加反应失去1 mol电子,1 mol NO参加反应失去3 mol电子,故有4V(O2)= V(NO2)+3V(NO2)。
