1.原电池正、负极的判断
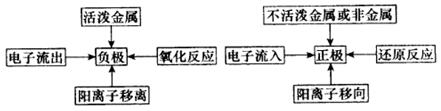
2.原电池电解质溶液中离子的移动规律
原电池的负极发生失电子的氧化反应,生成阳离子或消耗离子,故负极附近“阳盛阴衰”,为了保持溶液的电中性,阳离子移向正极,而阴离子移向负极。
3.原电池中电极反应式的书写技巧
(1)先确定原电池的正负极,列出正负极上的反应物质,并确定得失电子数目。
(2)注意负极反应生成的阳离子与电解质溶液中的阴离子是否能共存,若不能共存,则电解质溶液中的阴离子应写入负极反应式中。
(3)若已知总反应式时,可以先分析此反应中的氧化反应或还原反应(即分析有关元素的化合价变化情况),然后写出较易书写的电极反应式,将这个反应式看成数学中的代数式,用总反应式减去较易书写(一般为负极)的电极反应式,即得另一极的电极反应式。
4.可充电电池的反应规律
(1)可充电电池有充电和放电两个过程,放电时相当于原电池反应,充电时相当于电解池反应。
(2)放电时的负极反应和充电时的阴极反应、放电时的正极反应和充电时的阳极反应在形式上互逆。将负(正)极反应式变方向并将电子移项即可得出阴(阳)极反应式。
(3)放电总反应和充电总反应在形式上互逆,但不是可逆反应。