只需要点击下方QQ发送“高考化学解题模型”,就可以免费领取《高考化学解题模型》了!
1.ν-t 图象
如图I:
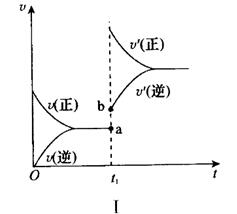
图象解析:(1)看改变条件的瞬间(t1),若ν(正)在ν(逆)上方,则平衡向正反应方向移动;反之,则平衡向逆反应方向移动。
(2)若a、b重合为一点,则t_1时刻改变的是某一物质的浓度。
(3)若a、b不重合,则t_1时刻可能是改变了温度或压强。
注:若ν(正)和ν(逆)改变程度相同,即ν(正)=ν(逆),平衡不移动,则t1时刻可能是使用了催化剂或是对反应前后气体体积不变的反应改变压强。
2.n-t 图象(或c-t图象或α-t 图象)
如图Ⅱ:
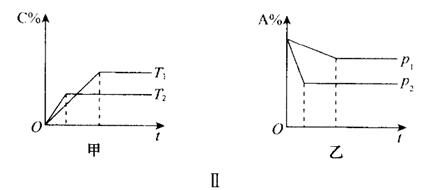
图象解析:先出现转折点的先达到平衡,即“先拐先平”原则,可以据此推出温度高低和压强大小。如图Ⅱ中p2﹥p1,T1﹤T2。然后再根据纵坐标表示的意义可分别推断出反应是吸热还是放热,或者反应前后气体物质的化学计量数之和的相对大小。
3.不同温度(或压强)下的平衡曲线
如图Ⅲ:
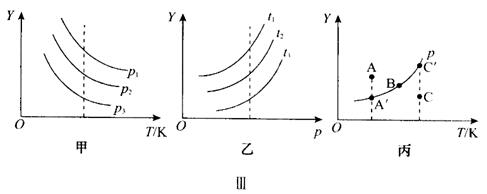
图象解析:(1)纵坐标Y可表示物质的量、浓度、转化率以及物质的量分数等含义。
(2)解题分析时,常需要作辅助线(对x 轴作垂线),横坐标表示温度(或压强),则此辅助线为等温线(或等压线)。
(3)如图Ⅲ丙所示,在曲线上的每个点(如B点)都是平衡状态,若纵坐标表示反应物的转化率,则有:
①A点是非平衡状态,若要达平衡,需降低转化率,即平衡要向逆反应方向移动,此点ν(正)﹤ν(逆)。
②C点是非平衡状态,若要达平衡,需增大转化率,即平衡要向正反应方向移动,此点ν(正)﹥ν(逆)。
③不管是否处于平衡状态,各点反应速率的大小主要由温度决定,故有ν(C)﹥ν(B) ﹥ν(A)。
4.不同温度对同一段时间内反应过程中某个量影响的图象
如图所示是不同温度下经过一段时间,某反应物的转化率与温度的关系。
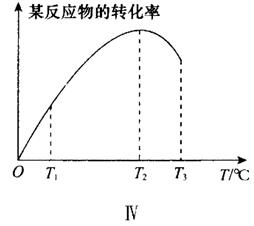
图象解析:(1)此图象表明该反应的正反应为放热反应。若正反应为吸热反应,则同一时间段内温度越高,平衡正向移动程度越大,反应物的转化率越大,曲线应一直为增函数,则与图象不符合。
(2) T1~T2段是随温度升高,反应速率加快,反应物转化率增大。
(3)平衡时,反应物的转化率达最大,即T2点为平衡点。
(4) T2~T3段是随温度升高平衡向吸热方向移动的结果。
