只需要点击下方QQ发送“高考化学解题模型”,就可以免费领取《高考化学解题模型》了!
1.看离子反应是否符合客观事实。如把Fe与HCl的反应错写成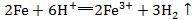 ,与反应事实不符。
,与反应事实不符。
2.看所用的生成符号、生成物状态是否正确。如盐的水解反应用“⇌”表示,生成物中不出现“↑”或“↓”;但双水解反应用“═”表示,且生成物中出现沉淀或气体要用“↓”或“↑”表示。
3.看各物质的拆分是否正确。如醋酸与碳酸钙的反应错写成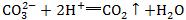 ,醋酸与碳酸钙分别是弱酸和难溶物,应写化学式。
,醋酸与碳酸钙分别是弱酸和难溶物,应写化学式。
4.看配平是否正确(质量、电荷、得失电子是否守恒)。如
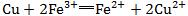 ,质量不守恒;
,质量不守恒;
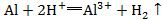 ,电荷不守恒;
,电荷不守恒;
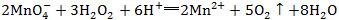 ,得失电子不守恒、质量不守恒。
,得失电子不守恒、质量不守恒。
5.看是否漏写离子反应。如Ba(OH)2和稀H2SO4的反应错写成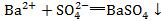 ,忽略了OH-和H+的反应。
,忽略了OH-和H+的反应。
6.看反应物或产物昀配比是否正确。如Ba(OH)2和稀H2SO4的反应错写成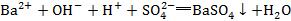 ,正确的离子方程式应为
,正确的离子方程式应为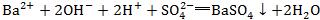 。
。
7.看量的关系。一般情况下,反应物的量不同则离子反应也有所不同。如向NaOH溶液中通入过量CO2,其离子方程式错写成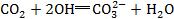 ,未注意到CO2过量,应生成HCO3-。
,未注意到CO2过量,应生成HCO3-。
8.看试剂的滴加顺序。如向Na2CO3溶液中滴加稀盐酸,开始时发生反应的离子方程式写成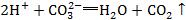 ,则与反应事实不符,因为向Na2CO3溶液中滴加稀盐酸,开始时H+与CO32-反应生成HCO3-。
,则与反应事实不符,因为向Na2CO3溶液中滴加稀盐酸,开始时H+与CO32-反应生成HCO3-。
9.看是否忽略了隐含的反应。如将少量SO2通入漂粉精溶液中的反应错写成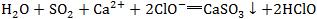 ,忽略了隐含的氧化还原反应:
,忽略了隐含的氧化还原反应: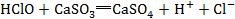 。
。
注意:在离子方程式书写或正误判断中易忽视的小问题:
1.混淆电离方程式和水解方程式。如将NaHS的水解方程式错写成: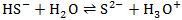 (电离方程式)。
(电离方程式)。
2.忽视反应环境
①在酸性环境中不能生成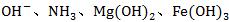 等。
等。
②在碱性环境中不能生成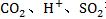 等。
等。
③在强氧化性环境中不能生成具有强还原性的物质,如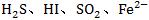 等,如Na2S溶液与硝酸混合不能生成H2S气体等。
等,如Na2S溶液与硝酸混合不能生成H2S气体等。
④在强还原性的环境中不能生成具有较强氧化性的物质,如氢碘酸与Fe(OH)3反应不能生成Fe3+等。
