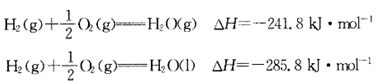
类型
放热反应。
注意
由上述反应式可知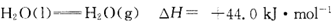
说明
①注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示构成物质的分子或原子的个数,因此化学计量数可以是整数,也可以是分数。
②注意反应物和产物的聚集状态不同,反应热数值以及符号都可能不同。因此,必须注明物质的聚集状态(s、l、g)才能完整地体现出热化学方程式的意义。热化学方程式中不用“↑”或“↓”
③注意热化学方程式是表示反应已完成的数量。由于∆H与反应完成物质的量有关,所以热化学方程式中化学式前面的化学计量数必须与∆H相对应,如果化学计量数加倍,则∆H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。所以反应1也可以写成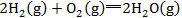
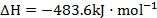 ;反应2可写成
;反应2可写成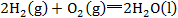
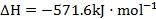 。
。
④热化学方程式中一般不需注明反应条件。