(1)电离平衡的特点
动:动态平衡,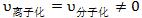 ;
;
定:达到平衡时溶液中离子、分子浓度保持不变;
变:外界条件改变,平衡发生移动。
(2)电离平衡的移动
影响弱电解质电离平衡有两方面的因素:一是电解质的结构和性质(内因),二是反应条件(外因)。
弱电解质的电离平衡是化学平衡的一种表现形式,完全具有化学平衡的特征和本质。可用化学平衡移动原理(勒夏特列原理)分析弱电解质的电离平衡(例如: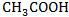 溶液)。
溶液)。
| 平衡移动方向 | 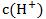
| 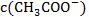
|
升高温度 | 向右 | 增大 | 增大 |
加水稀释 | 向右 | 减小 | 减小 |
加NaOH固体 | 向右 | 减小 | 增大 |
加浓硫酸 | 向左 | 增大 | 减小 |
加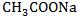 固体 固体 | 向左 | 减小 | 增大 |
加金属镁 | 向右 | 减小 | 增大 |